
搜索网站、位置和人员

电话: +86-(0)571-86886861 公共事务部
截止2021年5月初,新冠病毒(SARS-CoV-2)感染导致的全球死亡人数已超过320万。新冠病毒进入人体导致的过度肺部免疫炎症被认为是加重新冠肺炎(COVID-19)患者疾病的主要驱动因素,伴随急性呼吸窘迫、细胞因子风暴、淋巴细胞急剧减少等重症临床症状【1-5】。然而,关于COVID-19免疫致病机制的研究相当匮乏。由于抗体策略对COVID-19重症患者的治疗作用有限,明确这些病毒引起的免疫致病机制,是采取正确干预策略进行疾病治疗关键所在。
ACE2(血管紧张素转换酶2 )被认为是SARS-CoV-2侵染宿主细胞的主要受体。SARS-CoV-2 刺突(S)糖蛋白通过其受体结合域(RBD)与ACE2结合,随后,一些宿主丝氨酸蛋白酶,包括TMPRSS2等,在S1和S2片段之间的连接处切割SARS-CoV-2 S蛋白,促使宿主细胞膜和病毒融合,并将病毒基因组传递到细胞质中【6】。除ACE2外,现有研究表明neuropilin-1【7】,AXL【8】等也可能是SARS-CoV-2的潜在感染受体。已有研究揭示从COVID-19患者肺泡灌洗液分离的免疫细胞,特别是髓系细胞,可以检测到SARS-CoV-2病毒 RNA的存在【1,4】。但是,包括ACE2在内的这些受体分子在免疫细胞上表达量非常低,这提示可能还存在其他的受体分子介导了SARS-CoV-2和免疫细胞的相互作用以及致病机制。
针对这一疑问,纽约大学王俊教授、西湖大学生命科学学院谢琦研究员和圣路易斯华盛顿大学丁思远教授作为共通讯作者(王俊课题组博士后鲁峤、刘甲和谢琦课题组博士后赵帅为本文共同第一作者)近日在免疫学顶级杂志Immunity上发表题为“SARS-CoV-2 exacerbates proinflammatory responses in myeloid cells through C-type lectin receptors and Tweety Family Member 2”的研究论文(Research Article),为这一疑问提供了新的解释。

这项研究首次报道了SARS-CoV-2病毒与髓系细胞新受体的直接相互作用可以导致过度炎症反应的发生,并且证实了通过阻断病毒的S蛋白与髓系细胞受体的抗体策略可以有效降低过度炎症反应,为治疗COVID-19提供了新的方向。
该研究建立了一套高通量筛选髓系细胞膜受体的方法,通过在293T细胞中过表达髓系细胞膜蛋白文库,利用成像分析技术,鉴定出6种与SARS-CoV-2 病毒S蛋白结合的膜蛋白:C型凝集素受体(DC-SIGN、L-SIGN、LSECtin、ASGR1、CLEC10A)和一种通道蛋白,Tweety家族成员2 (TTYH2)(图1)。进一步研究表明, C型凝集素受体主要与S蛋白的非RBD(即N-端区域(NTD)或C-端区域(CTD))结构域结合,而TTYH2则和ACE2很相似,主要和S蛋白的RBD结构域结合。因为C型凝集素受体的结合和糖基化有关,文章还通过一系列的突变试验证明了SARS-CoV-2 病毒S蛋白多个糖基化位点和这些髓系细胞受体结合的重要性。
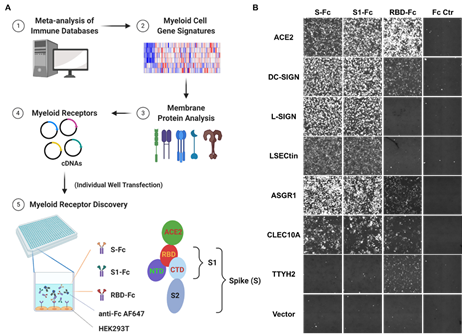
图1:通过高通量筛选鉴定SARS-CoV-2刺突蛋白(S)髓系细胞受体。A,高通量髓系细胞受体筛选原理。B,髓系细胞受体(DC-SIGN, L-SIGN, LSECtin, ASGR1, CLEC10A, 和TTYH2)可以与S蛋白所结合。
利用COVID-19患者肺泡灌洗液中的单细胞转录组数据【1,4】,研究人员发现除了ACE2阳性的肺表皮细胞含有病毒RNA之外,多种髓系细胞中也存在SARS-CoV-2病毒RNA。这些免疫细胞高表达DC-SIGN、L-SIGN、LSECtin、ASGR1、CLEC10A和TTYH2,但不表达ACE2(图2)。研究人员同时在从新冠病人肺泡灌洗液分离出的髓系细胞中通过细胞流式的方法确认了这些膜蛋白的表达。此外,肺泡灌洗液中表达免疫受体的髓系细胞表现出低水平的I型、Ⅱ型和Ⅲ型干扰素(IFNA2, IFNB1, IFNG, IFNL1),但表达高水平的炎症细胞因子和趋化因子,如IL1B,IL8,CXCL10,和CCL2 等(图2)。研究人员还发现,与非肺炎或细菌性肺炎患者相比,COVID-19患者的肺泡灌洗液样本中这些免疫受体和促炎细胞因子/趋化因子的特异性上调,提示它们在COVID-19中可能的致病作用。
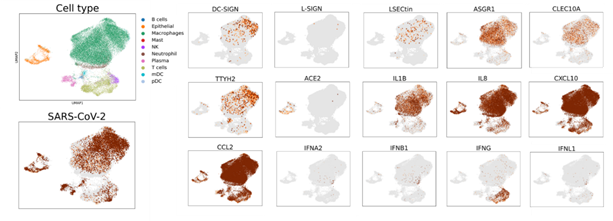
图2:COVID-19患者肺泡灌洗液中C型凝集素和TTYH2与病毒基因组在髓系细胞中的表达及其与免疫特征基因的关联。
通过一系列真病毒和假病毒的实验,研究人员发现SARS-CoV-2无法通过这些髓系细胞表面受体来感染免疫细胞,但是,SARS-CoV-2与髓系免疫细胞的相互作用可导髓系细胞产生大量的促炎性细胞因子(IL1A、IL1B、IL8、CXCL10、CCL2, CCL3等)(图3A)并上调炎症相关基因(EGR1、THBD、C4A和SOCS3)的表达。同时,研究人员通过对COVID-19患者肺泡灌洗液单细胞RNA测序分析发现这些炎症因子与疾病严重程度密切相关(图3B),并且和髓系细胞受体的表达也呈现一定的正相关性。有意思的是,与很多病毒和免疫细胞作用导致的免疫反应不一样,SARS-CoV-2和髓系免疫细胞的相互作用并不能导致I型,Ⅱ型和Ⅲ型干扰素的产生。 虽然已发现SARS-CoV-2可以通过多种机制,比如产生NSP或者ORF 蛋白来抑制肺表皮细胞产生干扰素来逃逸免疫系统对被感染细胞的检测【9】,该研究揭示SARS-CoV-2和免疫系统的一种直接作用方式,即通过这些髓系细胞表面受体的相互作用来直接影响免疫系统,特别是过度炎症反应的发生。
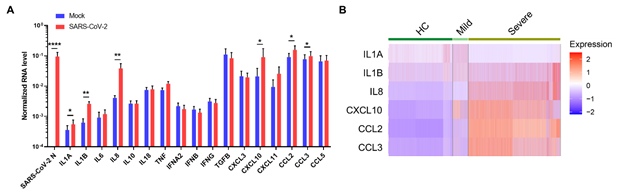
图3:SARS-CoV-2-髓系细胞相互作用促进过度炎症反应。A. 与SARS-CoV-2病毒作用后,髓系细胞中炎症因子的相关mRNA的转录水平显著提高。B. 单细胞测序结果表明这些炎症因子水平和COVID-19病症程度密切相关。
因为这些髓系细胞受体和SARS-CoV-2 S蛋白结合表位与ACE2受体很不一样,这些研究同时也为当前单纯针对SARS-CoV-2/ACE2感染途径的抗体治疗策略对新冠重症的不佳治疗效果提供了合理解释。研究者从羊驼纳米抗体库中筛选了大量VHH抗体。基于纳米抗体可以结合比较宽的抗原表位的特点,以及对髓系细胞受体以及ACE2受体的不同阻断模式,研究人员筛选并设计了双特异性纳米抗体。该双抗可以在生化层面上广泛阻断S蛋白与髓系细胞受体以及ACE2受体的结合。重要的是,该抗体不仅能有效阻止SARS-CoV-2通过ACE2受体感染宿主细胞(EC50低至0.09ug/ml),也能有效阻断SARS-CoV-2通过髓系细胞受体引发的过度炎症反应(图4)。
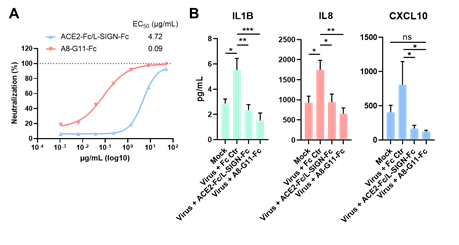
图4:双特异性纳米抗体能有效阻断SARS-CoV-2通过ACE2受体感染宿主细胞(A),同时能有效阻断病毒通过髓系细胞受体产生的过度炎症反应(B)。
综上所述,这些数据表明SARS-CoV-2与免疫细胞受体相互作用促进免疫过度活化反应,并且提出利用双特异性纳米抗体一箭双雕同时阻断免疫过度活化以及感染途径可作为COVID-19重症疾病的一种潜在的治疗策略(图5)。
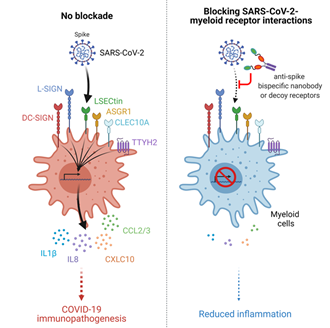
图5: SARS-CoV-2促进髓系细胞过度免疫反应及抗体阻断策略模式图。在没有抗体阻断的情况下,SARS-CoV-2病毒可与髓系细胞受体相互作用,从而引发大量炎症因子的释放并产生过度炎症反应。在抗体阻断的情况下,病毒无法刺激髓系细胞产生大量细胞因子,从而减轻患者的炎症反应。
西湖大学谢琦研究员为本研究的共同通讯作者,西湖大学博士后赵帅为本文共同第一作者,西湖大学周强课题组也为该研究提供了帮助。该项研究得到了西湖大学教育基金、腾讯基金、杭州市科技发展基金的支持。
原文链接:https://www.cell.com/immunity/fulltext/S1074-7613(21)00212-0
西湖大学谢琦博士一直从事肿瘤干细胞以及干细胞和所在的肿瘤微环境互作的相关研究,从表观遗传学,转录调控水平,翻译后修饰水平以及代谢水平对其进行了系统性研究, 取得了一系列的研究成果,研究成果以第一作者或通讯作者身份发表在Cell, Cancer Discovery, Immunity, Nature Neuroscience,Cell Research, Journal of Clinical Investigation等国际著名杂志上, 并多次应邀在干细胞领域顶级杂志Cell Stem Cell 上发表评述和综述文章。欢迎优秀的博士研究生和博士后人才加入我们的研究团队推动相关课题。有意者可以email谢琦博士(xieqi@westlake.edu.cn), 长期有效。
参考文献:
1. Bost, P., Giladi, A., Liu, Y., Bendjelal, Y., Xu, G., David, E., Blecher-Gonen, R., Cohen, M., Medaglia, C., Li, H., et al. (2020). Host-Viral Infection Maps Reveal Signatures of Severe COVID-19 Patients. Cell 181, 1475-1488.e1412.
2. Diao, B., Wang, C., Tan, Y., Chen, X., Liu, Y., Ning, L., Chen, L., Li, M., Liu, Y., Wang, G., et al. (2020). Reduction and Functional Exhaustion of T Cells in Patients With Coronavirus Disease 2019 (COVID-19). Front Immunol 11, 827.
3. Giamarellos-Bourboulis, E.J., Netea, M.G., Rovina, N., Akinosoglou, K., Antoniadou, A., Antonakos, N., Damoraki, G., Gkavogianni, T., Adami, M.E., Katsaounou, P., et al. (2020). Complex Immune Dysregulation in COVID-19 Patients with Severe Respiratory Failure. Cell host & microbe 27, 992-1000 e1003.
4. Liao, M., Liu, Y., Yuan, J., Wen, Y., Xu, G., Zhao, J., Cheng, L., Li, J., Wang, X., Wang, F., et al. (2020). Single-cell landscape of bronchoalveolar immune cells in patients with COVID-19. Nature Medicine 26, 842-844.
5. Moore, J.B., and June, C.H. (2020). Cytokine release syndrome in severe COVID-19. Science 368, 473-474.
6. Hoffmann, M., Kleine-Weber, H., Schroeder, S., Kruger, N., Herrler, T., Erichsen, S., Schiergens, T.S., Herrler, G., Wu, N.H., Nitsche, A., et al. (2020). SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell 181, 271-280 e278.
7. Cantuti-Castelvetri, L., Ojha, R., Pedro, L.D., Djannatian, M., Franz, J., Kuivanen, S., van der Meer, F., Kallio, K., Kaya, T., Anastasina, M., et al. (2020). Neuropilin-1 facilitates SARS-CoV-2 cell entry and infectivity. Science 370, 856.
8. Wang, S., Qiu, Z., Hou, Y. et al. (2021). AXL is a candidate receptor for SARS-CoV-2 that promotes infection of pulmonary and bronchial epithelial cells. Cell Res 31, 126–140.
9. Lei X, Dong X, Ma R, et al. Activation and evasion of type I interferon responses by SARS-CoV-2. Nature Communications. 2020;11(1):3810.
最新资讯
学术研究
学术研究
学术研究
学术研究

















