
搜索网站、位置和人员

电话: +86-(0)571-86886861 公共事务部
物以类聚,人以群分。这句中国人说了2000多年的老话,如果类比到研究上,前者关乎自然研究,后者关乎社会研究。
你看,宇宙本就是从凝聚开始——宇宙大爆炸后约38万年,物质开始通过引力作用聚集。而在你的生命宇宙里,在细胞内部,蛋白质们无时无刻上演着相聚又分离的故事。西湖大学张鑫实验室,研究方向之一正是生物分子凝聚体。要知道,蛋白质的分分合合,关乎到细胞各种生理过程,而他们一直在探寻背后的规律。近期,张鑫实验室先后在《美国化学会志》和《自然-化学生物学》上发表两项研究,分析了小分子对生物凝聚体微环境的影响,并尝试通过小分子调控生物分子凝聚体的行为和功能。进一步,他们探究了小分子药物与凝聚体微环境之间的定量相关性,为小分子药物设计提供新视角。

2009年,科学家在线虫细胞里首次发现了液滴状的生殖颗粒。这些液滴状态的物质是一种无膜细胞器,没有传统认知上的“外壳”,或者说膜结构,而是通过形成液态的聚集体来执行生命任务。
这一发现打开了人类对细胞内结构的新认知。不同的无膜细胞器聚体互不融合,但又分工协作,共同完成细胞内重要的生理过程。
十余年来,对于多层无膜细胞器的科学研究主要聚焦于生命发育、免疫、疾病等重要生命过程的作用。而张鑫团队在这一领域保持了多年的持续研究,他们曾提出微观极性对于生物凝聚体分层结构的关键性控制作用,也揭示过离子在调节凝聚体物理化学微环境方面的作用。
这次,他们瞄准了小分子和凝聚体的关系——这和药物作用更近了一步。在介绍他们的工作前,我们先做一个铺垫,了解一个生物聚集体的基本物理性质——极性和粘度。
何谓极性?简单地说,它与分子电荷分布有关。分子电荷分布越不均匀,极性就越大。比如水分子就是一个典型的极性分子,水分子之间倾向于相互吸引,水滴就是如此形成。
宏观物质的一些物理性质,如溶解性大小、熔点高低、沸点高低等等,其实都与分子的极性相关。而生物凝聚体的微观极性,可以看作是小范围内分子极性的总和,我们也可以用物理中的介电常数来评估这种极性。
何谓粘度?粘度是衡量流体内部抵抗流动能力的物理量,它反映了流体层之间因内摩擦力而产生的阻力。通俗地说就是 “稠”或“稀”的程度,类比于你煮粥的时候,用勺子搅拌时感受到的“阻力”。

此项研究的一作潘逸飞(右)和二作雷俊麟
再回到实验。
张鑫团队从基本的尝试出发,以几种常见的有机溶剂分子作为他们研究的模式分子。初步的实验表明,凝聚体的物理微环境变化受到蛋白质、小分子和水分子三者相对作用强弱的共同影响。
有趣的是,不同的分子,在对凝聚体的极性和粘度影响上,表现出明显的“偏好”,出现了“两极分化”。
在所选择的模式分子中,具备单一氢键受体的小分子倾向于降低凝聚体的微极性,并提高微粘度;而具有多个氢键受体或能够与多个水分子形成复合物的小分子则倾向于增加微极性,并降低微粘度。
张鑫团队分析,这一现象的可能原因在于,前者更倾向于与水分子竞争,进而通过氢键与蛋白质的酰胺键结合,从而减少凝聚体内水分子的数量;而后者则通过多个氢键受体的作用,向凝聚体内引入更多的水分子,提高了微极性,降低了微粘度。
摸索到这层规律后,也相当于给调控凝聚现象找到新可能。随后,张鑫团队把实验推及到两种蛋白质混合形成的凝聚体。
一开始,团队选择了两种具有不同极性的蛋白质进行混合,形成具有多层结构的凝聚体液滴。然后,通过加入小分子调节凝聚体的微极性,从而控制多层液滴之间的混溶互溶情况。
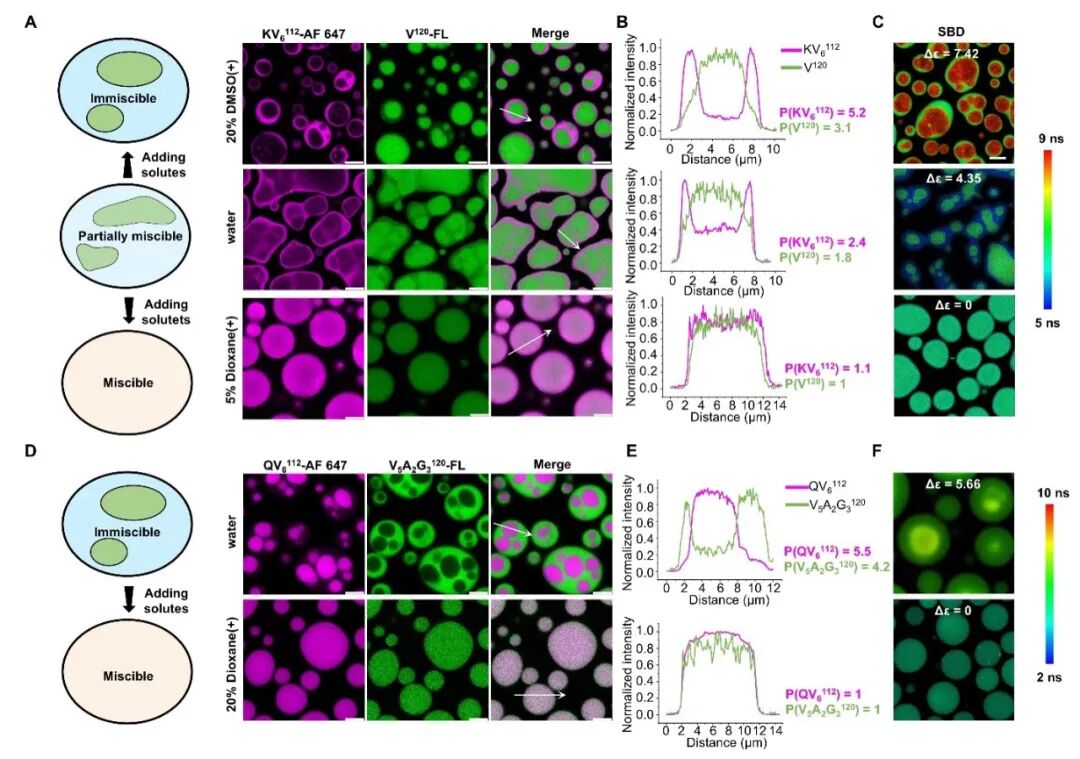
小分子通过调节微极性差异改变多层液滴混溶互溶状态
不同小分子的调节能力,同样出现了“两极分化”——
随着不同层液滴之间微极性差距的增大,液滴之间的混溶程度逐渐减小;相反,随着微极性差距的减小,液滴的混溶程度增加,从不混溶或部分混溶的状态逐步转变为完全混溶的状态。
此外,团队还发现凝聚体微环境的极性变化,可以调控化学反应的速率和平衡,这里我们不多展开。
想象一下,生命活动充满了各种化学反应,而很多就是在这样的凝聚体微环境中进行的。随着凝聚体的聚集和分离,改变的不仅是反应的物理空间,也调控着反应速度,如同一场群舞里,舞者的聚与散,音乐的疏与密。
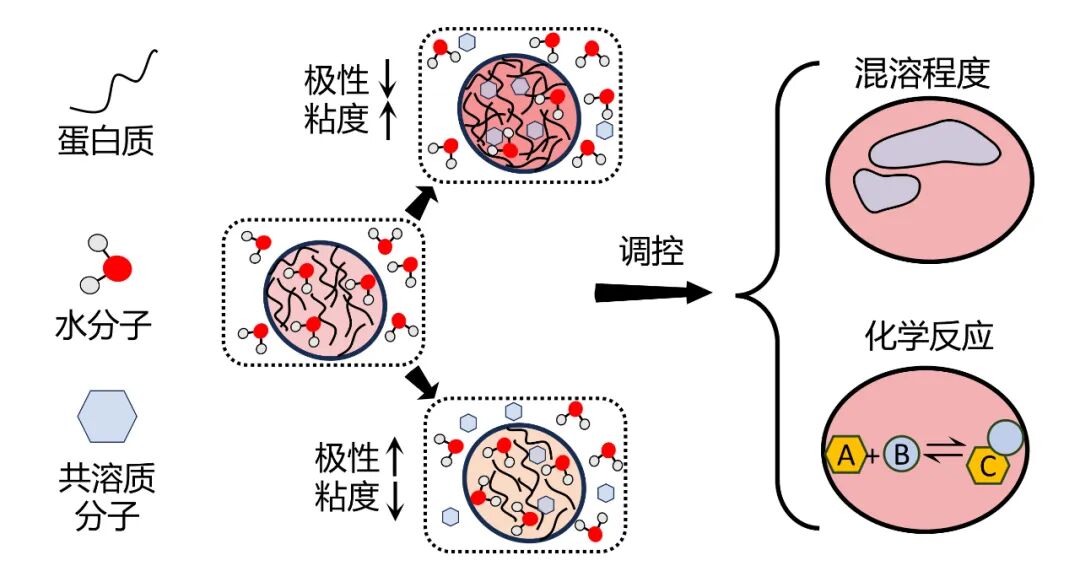
凝聚体的物理微环境变化受到蛋白质、小分子和水分子三者相对作用强弱的共同影响
又也许,人类也可以理解并利用小分子和凝聚体的作用机制,这就涉及到张鑫团队的另一项研究,这项研究和北京大学基础医学院李婷婷教授课题组合作开展。
他们发现,凝聚体的微环境特性,特别是微极性,对小分子药物的分布和靶点结合效率具有决定性影响。
他们的“调查”先从已经进入临床的小分子药物入手。
李婷婷团队利用生物信息学手段,结合大数据分析,梳理了2100余种FDA批准的小分子药物数据,发现针对靶向相分离状态(PS)蛋白质的药物,其疏水性(以logP值衡量)显著高于靶向非相分离蛋白(NPS)的药物。所谓的相分离蛋白,简单来说,就是能够形成凝聚体的蛋白质。
这里需要科普下亲水性或者疏水性的概念,两者和微极性息息相关,极性大表现为亲水性高,极性小表现为疏水性高。
因为张鑫团队在凝聚体微极性的工作,李婷婷和张鑫开展了深入讨论,他们猜想,也许只有足够疏水的小分子,才更有可能富集于凝聚体内。这一猜想也许也同样适用于人类代谢物——与PS蛋白相关联的代谢物同样更具疏水性。

本项研究共一作者陈俊霖
更仔细的调查继续。
研究团队从药物的靶向蛋白结构入手。简单来说,小分子药物要发挥作用,它会有一个体内的目标蛋白去结合或者影响,也就是靶向蛋白。
他们重点关注蛋白质的内在无序结构域(IDRs),因为IDRs在生物凝聚体形成过程中的具有关键作用。所谓的内在无序结构域,是指蛋白质中缺乏稳定的三维结构、在生理条件下以动态构象集合存在的区域。
李婷婷研究团队从TTD和DrugBank两个数据库中获得了306个PS蛋白,其中有202个被发现携带较长的IDRs。他们根据IDRs的氨基酸种类、数量、排布方式等差异,对这些蛋白进行了聚类分析。
最终他们被分为四类:非极性残基富集类、亲水性残基富集类、正负电荷成块分布类和一般带电荷类。他们又进一步收集了与各IDR亚类相关的小分子药物,并对它们的疏水性进行了比较分析。
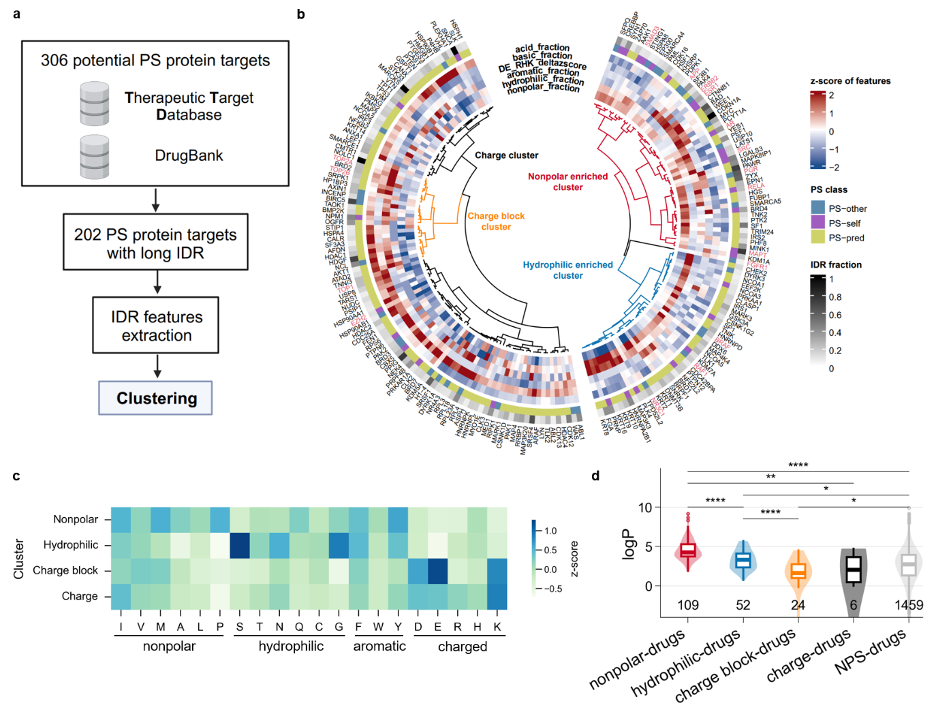
IDRs聚类分析揭示了凝聚体微环境的异质性
结果发现,靶向非极性残基富集类IDRs的小分子药物具有最高的疏水性,其次依次为靶向亲水性残基富集类、非PS蛋白(NPS)靶点、正负电荷成块分布类和一般带电荷类。
这种明显的相关性,让研究团队十分兴奋——小分子药物的疏水性与其所靶向相分离蛋白聚类分组的化学特性呈正相关。
而后续的实验也进一步确认了这种分类的准确性。张鑫研究团队利用荧光寿命成像技术,结合微极性敏感小分子O-SBD-Halo,将不同IDRs片段形成的凝聚体进行微极性的定量分析。
其结果证明了富含非极性氨基酸(如丙氨酸、异亮氨酸)富集的IDRs形成的凝聚体,其内部更为疏水;可能倾向于富集更具疏水性的小分子。相反,带极性氨基酸为主的IDRs形成的凝聚体,则更亲水。
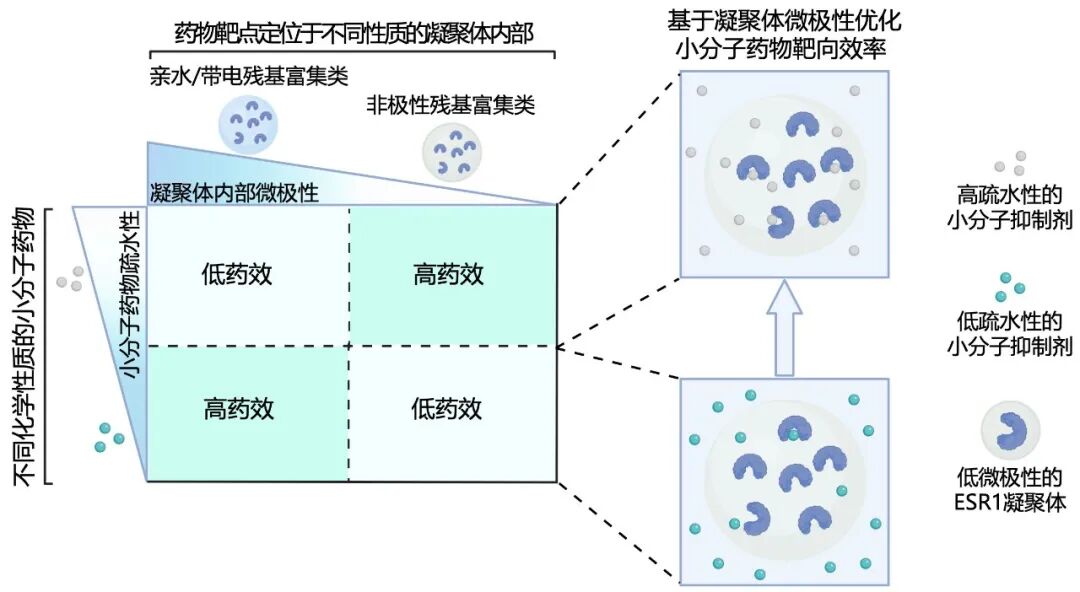
调控凝聚体微环境以提升小分子药物靶向效率示意图
为了进一步证实疏水性的小分子更加富集到疏水性的凝聚体中,张鑫研究团队继续以乳腺癌治疗靶点ESR1蛋白为实验对象,通过细胞实验和质谱实验证明:在形成ESR1凝聚体的微环境中,疏水性高的药物(如Tamoxifen)比同等亲和力但疏水性低的药物更有效。
这是因为它们能更好地“穿越”到凝聚体中,实现高浓度富集。
至此,这项研究首次提出并实验证实了一个新原则,在设计靶向PS蛋白的小分子药物时,除了关注靶点亲和力外,还必须考虑其所处凝聚体的微环境特性,尤其是疏水性匹配。研究团队期待,在未来,疏水性匹配有望成为提高药物有效性与选择性的关键策略,推动精准医学更进一步。

研究历程回顾
2023年11月16日,张鑫团队在《自然-化学生物学》发文,系统性地揭示了微观极性对于生物凝聚体分层结构的关键性控制作用。
这篇论文,标志着张鑫团队在生物凝聚体研究上的第一步。到了2024年的5月10日,团队在《美国化学会志》上发表研究成果,揭示了离子在调节凝聚体物理化学微环境方面的作用。
以及,本文介绍的两项研究。2025年6月15日,他们在《美国化学会志》发文揭示小分子影响凝聚体物理微环境,以及9月9日在《自然-化学生物学》提出调控凝聚体微环境以提升小分子药物靶向效率。
而其中的研究脉络已然显现——从底层原理出发,探寻生物凝聚体的基本机制,并寻找调控方法,最后更近一步,寻找能够指导药物研发的理论。
张鑫实验室网站
xinzhang.lab.westlake.edu.cn
致谢
研究一 | 小分子影响凝聚体物理微环境
西湖大学理学院博士生潘逸飞为文章第一作者,西湖大学理学院化学系张鑫教授为文章通讯作者,西湖大学理学院博士生雷俊麟、牟世启、朱龙琛、罗峰,科研助理吴治丽、丁雅萍,博士后曾立尧为该工作提供了帮助,中国科学院大连化物所刘宇研究员对本项研究提供了宝贵的意见。本项目得到了国家自然科学基金(22494700, 22494702, 22477102)、西湖大学未来产业研究中心、西湖实验室的资助,项目实施过程中得到了西湖大学分子科学公共实验平台的大力支持。
研究二 | 调控凝聚体微环境以提升小分子药物靶向效率
最新资讯
学术研究
大学新闻
人物故事
大学新闻

















