
搜索网站、位置和人员

电话: +86-(0)571-86886861 公共事务部
北京时间2021年3月24日,西湖大学周强课题组和瑞士苏黎世联邦理工学院的Karl-Heinz Altmann课题组合作,在《细胞发现》(Cell Discovery)杂志在线发表了题为“Mechanism of substrate transport and inhibition of the human LAT1-4F2hc amino acid transporter”(“人源氨基酸转运蛋白复合物LAT1-4F2hc的底物结合和抑制机理)的研究长文。文章解析了多种抑制剂与LAT1结合的高分辨率电镜结构,进一步阐明了LAT1-4F2hc复合物的底物运输机制,为靶向肿瘤氨基酸代谢的药物开发提供了重要线索。
LAT1-4F2hc是人体内的一种氨基酸转运蛋白复合物,属于异源多聚体氨基酸转运蛋白(HAT)家族。该家族成员由轻链蛋白和重链蛋白构成。LAT1是其中的轻链蛋白,负责转运大的不带电的氨基酸(如亮氨酸等)和荷尔蒙小分子等底物。4F2hc是其中的重链蛋白,具有介导转运复合物细胞膜定位和维持轻链蛋白稳定性的作用。LAT1-4F2hc在多种肿瘤细胞中过量表达,可为肿瘤细胞提供生长所需的营养物质,当抑制LAT1-4F2hc的底物运输功能时,能够明显降低肿瘤的生长速率,因此被认为是重要的抗癌靶点。周强课题组在2019年首次解析了人源LAT1-4F2hc复合物朝向胞内开口(Inward open conformation)的高分辨率电镜结构,初步揭示了LAT1-4F2hc的底物识别和转运机理。
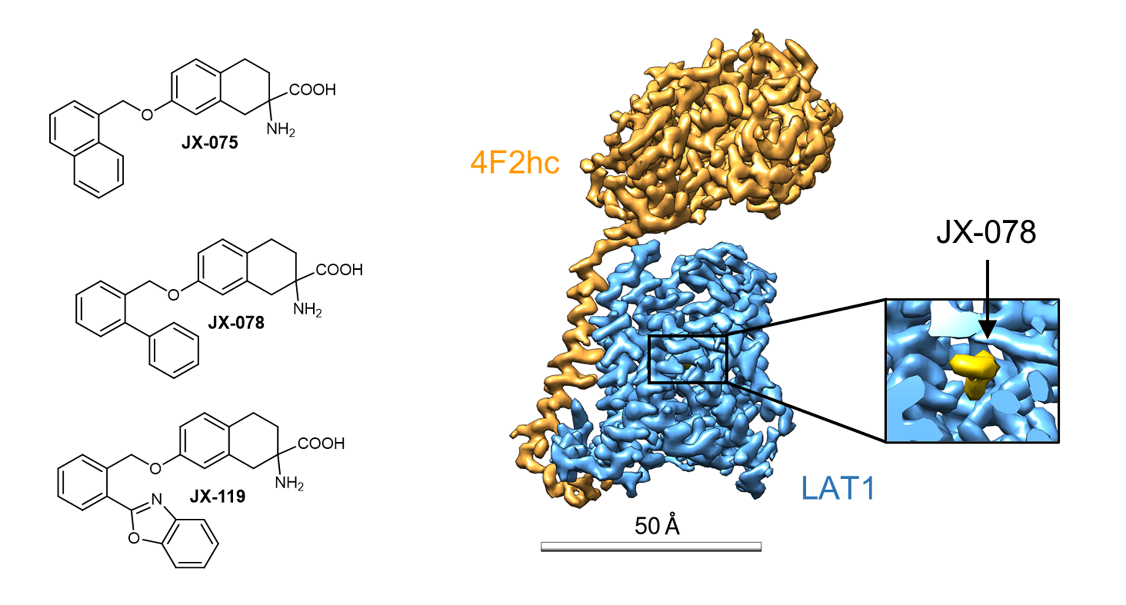
图注:三种JX抑制剂的化学式(左);结合JX-078的 LAT1-4F2hc复合物的冷冻电镜密度图(右)。
在此基础上,课题合作者Karl-Heinz Altmann教授的课题组通过对目前已经报道的LAT1抑制剂进行结构分析,设计并合成了三种新型的LAT1抑制剂: JX-075, JX-078, 和JX-119,IC50抑制效果均能达到100-200 nM级别。周强课题组通过冷冻电镜技术对这三种抑制剂结合状态下的LAT1-4F2hc复合物进行解析,发现这三种抑制剂均结合在LAT1的底物结合位点上,抑制剂的氨基和羧基分别同LAT1的TM1和TM6解旋区的骨架形成氢键作用,而抑制剂的疏水性尾巴则和LAT1的TM3、TM6和TM10发生相互作用,并部分破坏了TM3和TM10的二级结构,使得该区域无法形成螺旋,最终使LAT1的构象维持在朝向胞外的封闭状态(Outward occluded conformation)。此外,文章还解析了此前已经报道过的抑制剂3,5-diiodo-L-tyrosine结合LAT1的高分辨率电镜结构,该抑制剂虽然也结合在LAT1的底物结合位点上,但与JX系列抑制剂不同的是,它可能是通过苯环上被取代的碘分子所产生的空间位阻来行使抑制作用的,而不需要通过破坏TM3和TM10的二级结构来稳定LAT1构象。进一步的结构比对分析表明3,5-diiodo-L-tyrosine结合的LAT1可能处于朝向胞外开口封闭状态到朝向胞外开口开启状态的中间态。这些抑制剂结合的LAT1-4F2hc复合物结构为下一步设计更加强效的抗癌药物提供了重要线索。
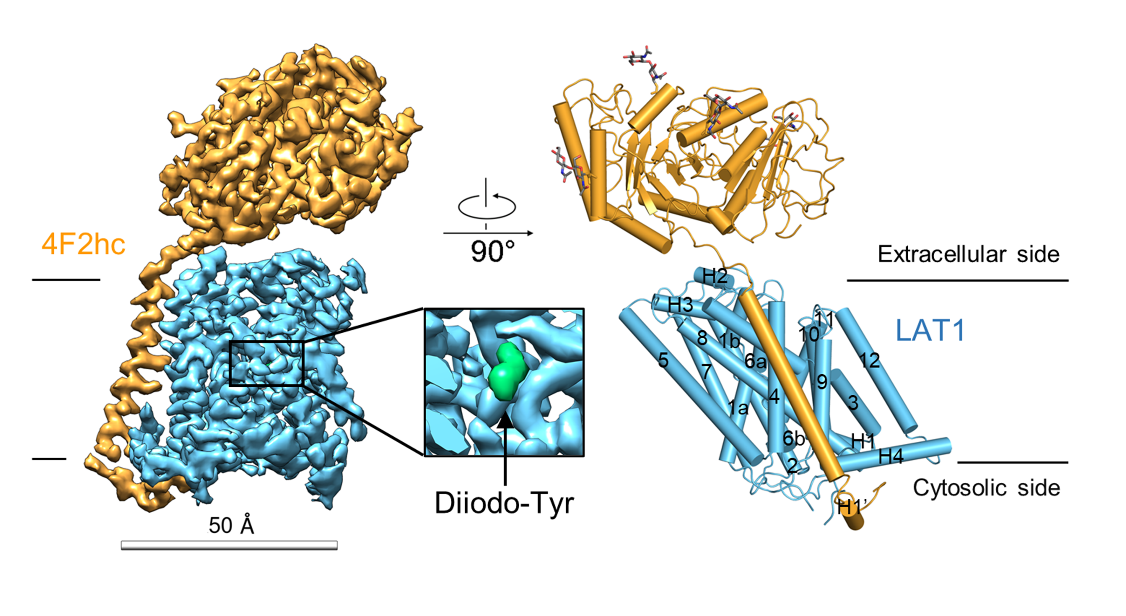
图注:结合3,5-diiodo-L-tyrosine的 LAT1-4F2hc复合物的冷冻电镜密度图(左)及结构模型(右)。
西湖大学研究员周强、瑞士苏黎世联邦理工学院Karl-Heinz Altman教授为论文共同通讯作者,西湖大学博士后鄢仁鸿、清华大学博士生李雅宁、苏黎世联邦理工学院Jennifer Müller博士、周强课题组科研助理张媛媛为本文的共同第一作者。本项目得到国家科技部基金、国家自然科学基金、瑞士国家科学基金、浙江省重点研发计划、中国博士后科学基金、博士后创新计划等的支持。冷冻电镜数据在西湖大学冷冻电镜平台收集,西湖大学高性能计算中心为本研究的数据处理提供了支持。
文章链接:https://www.nature.com/articles/s41421-021-00247-4
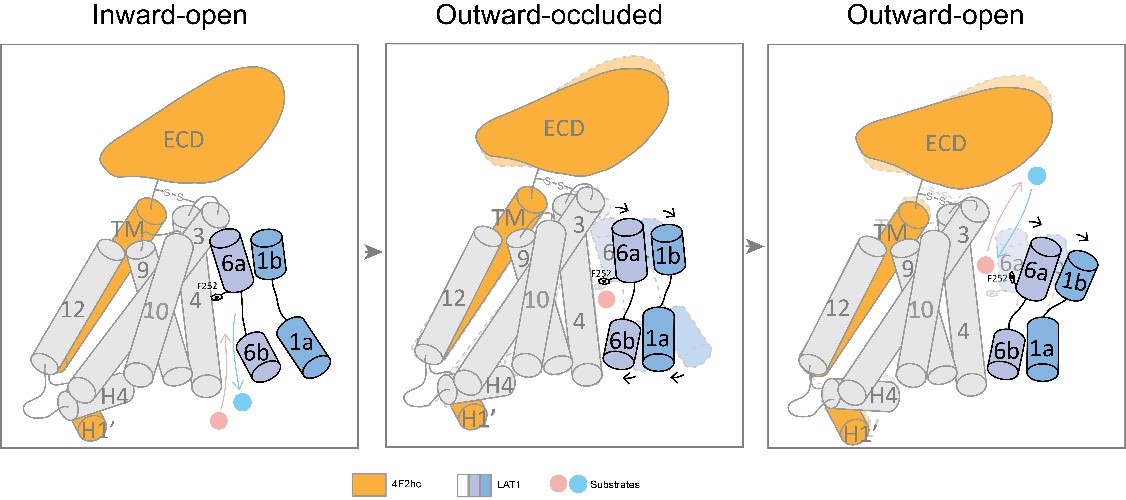
图注:LAT1-4F2hc复合物的工作模式图。
最新资讯
学术研究
学术研究
学术研究
学术研究

















