
搜索网站、位置和人员

电话: +86-(0)571-86886861 公共事务部
2022年11月17日,西湖实验室、西湖大学生命科学学院和《科学》/美国科学促进会(Science/AAAS)联合举办的第一期Symposium顺利举行,主题为“基因编辑”(Gene Editing)
本期邀请了三位基因编辑研究领域的知名学者,分别是来自麻省理工学院-哈佛大学博德研究所的David R. Liu博士、中国科学院遗传与发育生物学研究所的Caixia Gao博士和麻省理工学院怀特海德研究所/科赫研究所、霍华德·休斯医学研究所的Jonathan Weissman博士,分享他们激动人心的科学发现,并讨论基因编辑领域的关键问题。
西湖大学生命科学学院特聘研究员马丽佳博士和《科学》/美国科学促进会资深编辑江涤博士共同主持本次研讨会。
主持人马丽佳博士和资深编辑江涤博士
研讨会采用线上直播的形式,让全球的思想碰撞毫无阻碍,与会者来自海内外高校、医院、科研机构、药企等单位,累计超过20600人次观看本次直播。
来自美国的哈佛大学和博德研究所的David Liu博士对开发的碱基编辑器及其应用和优化以及新开发的递送系统进行了介绍和分享。
作为基因编辑的领域的领军人和碱基编辑器的开发者,David Liu博士在基因编辑领域建树丰硕,走在基因编辑的前沿。他和他的团队在2016年开发了胞嘧啶碱基编辑器CBE(C-T,G-A),2017年开发了腺嘌呤碱基编辑ABE(A-G,T-C),2019年开发了先导编辑器(primer editor,PE),2022年开发了线粒体碱基编辑器。这些碱基编辑器在工作时不依赖DSB的产生,也不需要供体DNA的参与,在由碱基突变引起的基因遗传疾病的治疗有着较为广泛的应用。
DNA碱基编辑和先导编辑系统作为纠正人类基因组中致病突变的治疗工具有显著的潜力,超过25%的人类致病性SNP可以通过靶向4个碱基(C-T,G-A,A-G,T-C)转换突变进行校正。而PE可有效实现所有12种单碱基的自由转换,理论上,PE可以纠正高达89%的已知与人类疾病相关的遗传变异。
碱基编辑器在动物疾病模型的治疗中取得了很好的疗效。2021年Nature发表了利用ABE治疗小鼠镰状细胞病,将编辑后的造血干细胞注射到小鼠体内,缺氧诱导的镰状细胞减少了5倍,表明ABE可以在体内持久编辑。2020使用ABE直接纠正来自早衰症儿童和HGPS小鼠模型中培养的成纤维细胞中的致病性突变HGPS。人LMNA c.1824 C>T等位基因纯合的转基因小鼠中,在出生后第14天单次注射表达ABE的AAV9可提高活力,并将小鼠的中位寿命从215天延长到510天。
David Liu团队还针对AAV递送系统包装的有限性以及疾病中PAM序列的限制,同时开发了不同核酸酶的碱基编辑器,可用AAV递送碱基编辑器进行疾病治疗。目前碱基已有多项已在临床中使用,主要是CAR-T治疗,以及LDL-C和SCD的治疗,目前都处于临床一期。碱基编辑器可以在体内外纠正突变甚至在某些情况下成功挽救疾病表型。
然而CBE和ABE组合使用可以有效地进行4种碱基转换,即C→T、G→A、A→G、T→C的突变类型,其他类型的突变占已知致病突变的70%,依然缺乏有效的研究工具。为了解决这个问题,David Liu团队开始着手寻找其他同样不需要DSB和供体DNA模板的方法来进行直接安装或纠正转换、删除和插入碱基,实现精确的基因编辑,挽救疾病表型。2019年10月David Liu团队率先推出了先导编辑系统(Prime Editing),这项突破性成果也发表在了Nature杂志上。
先导编辑是一种基于“搜索和替换”(search-and-replace)的基因组编辑方式。先导编辑的开发基于Cas9n(H840A)、MMLV逆转录酶的融合和pegRNA,构成了基础版本的PE1和PE2,pegRNA不仅要编辑靶标DNA还编码了所需要的模板序列,首先在靶标链形成单缺口,pegRNA的3’端PBS区(prime binding site)与含PAM的DNA链形成杂交链,含有编辑的逆转录模板在逆转录酶作用下启动pegRNA上延伸的反向转录连接至断口的DNA链上。
后续的实验确认了PE在多个细胞系和位点具有精确的编辑效率。相对Cas9来说,PE具有更高的特异性,更低的脱靶效率。同时David Liu博士讲到,可以使用PE的一条pegRNA对有多个突变的CSKL5基因进行修正。PE自开发以来进行了多次升级和优化,与先前的碱基编辑器相比,PE编辑器的优势在于RT模板完全由使用者自行决定,即PE可以在同样精准不引入DSB和不使用供体模板的背景下,高效完成所有类型的单碱基转换和小型插入和缺失,展现出了较高的特异性。
最后,David Liu博士介绍了病毒样颗粒(VLP)。针对体内基因编辑递送系统,病毒递送和非病毒的LNP递送各有优劣,David Liu团队最近报道了一种体内基因编辑蛋白递送系统的改进版本:V4-eVLP。作为潜在的药物递送载体,VLP是由携带分子货物的病毒蛋白组成的小型结构,但不包含病毒的遗传物质,也不会引起感染。由于VLP缺乏病毒的遗传物质,它们可能比其他使用实际病毒的递送方法更安全,因为病毒可能将其遗传物质插入细胞的基因组中并可能导致癌症。将eVLP单次注射到小鼠体内介导了多个器官(包括大脑,肝脏和视网膜)中各种靶基因的有效碱基编辑。在肝脏中,eVLP强烈降低血清Pcsk9水平,在视网膜中,eVLPs部分恢复了遗传盲小鼠模型中的视觉功能。更重要的是,V4-eVLP搭载的碱基编辑器在体内的脱靶效率要低于用AAV搭载的碱基编辑器,这为临床试验的安全性奠定了非常重要的基础。

David R. Liu博士做报告
在第二部分,基因编辑农业领军人物--高彩霞博士,详细为我们解答了如何利用基因组编辑下一代植物育种技术解决传统育种的瓶颈问题,从而实现基因组定向修饰与精准育种。
传统的植物育种技术主要包括杂交育种和诱变育种,随着基因工程技术的发展,转基因育种技术开始被利用,成为新的育种技术,但这些方法均需要反复回交,将目标性状引入到原有品系中,往往耗时长达8-12年。
高彩霞团队利用基因枪瞬时表达CRISPR/Cas9系统的小麦遗传转化方法,省去了繁琐的回交步骤,实现了小麦无外源基因残留、低脱靶率的快速高效基因编辑。该方法不仅能应用于小麦,在其他不同作物中同样具有广谱应用潜力,为培育抗病高产作物品种提供了新的策略和技术路线。
小麦白粉病在我国普遍发生,严重影响小麦产量和品质。MLO基因不仅是白粉病的感病基因,同时也参与调控小麦的其他生理特性。已知MLO在小麦中有三个同源基因,分别位于4B、4D、5A染色体上,在2014年发表的文章中,高彩霞团队与合作者通过一对TALENs将小麦的TaMLO基因全部敲除后可获得良好的白粉病抗性,但是编辑后的小麦(mlo突变体)表现出了早衰和株高与产量下降的问题。
幸运的是,在筛选mlo基因小麦突变群体时,研究团队发现一株编号为Tamlo-R32的突变体在表现出对白粉菌抗性的同时,生长发育和产量完全正常。通过对Tamlo-R32的全基因组测序分析发现。除了在4D、5A染色体上具有预想的编辑结果外,在4B染色体上存在304 kb的片段缺失。该缺失片段的右侧为靶向的TaMLO-B1,左侧为一个新发现的基因TaMLOX。
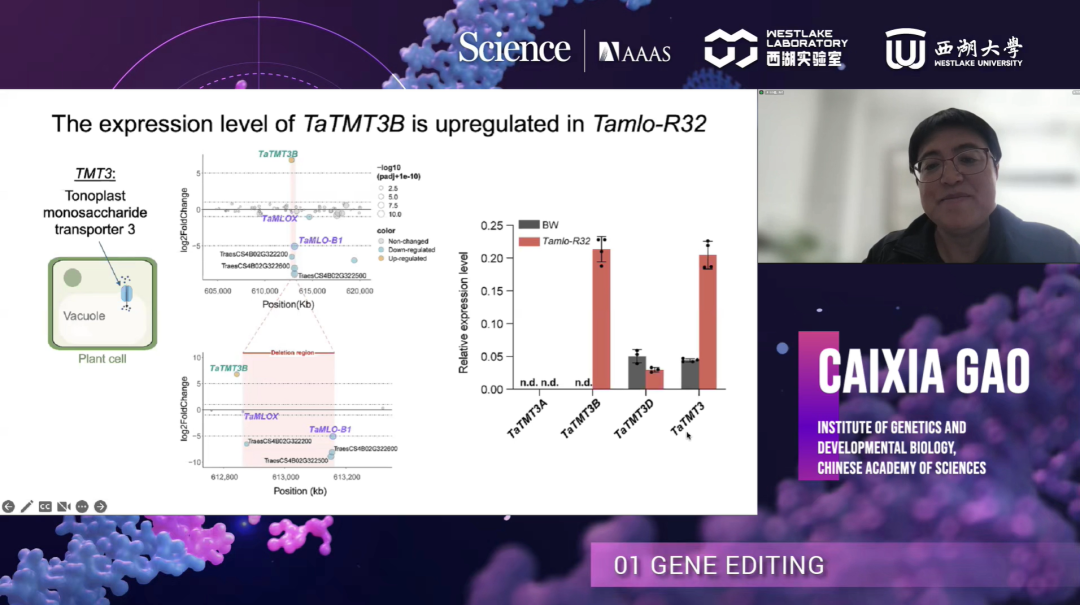
随后,为了研究这种大片段缺失的影响,研究团队利用RNA-seq、qRT-PCR等方法检测了缺失位点附近基因的表达。发现304 kb缺失片段邻近的TaTMT3B表达上调。TMT3是液泡膜单糖转运蛋白,在拟南芥中过表达可以提高种子产量。
后续研究发现,该大片段缺失造成TaTMT3B上游的抑制性表观遗传修饰的丢失,进而上调了TaTMT3B的表达。敲除Tamlo-R32突变体中的TaTMT3B可以重现mlo突变体株高产量下降的表型;在mlo突变体中过表达TaTMT3B在不影响白粉病抗性的同时可以挽救株高产量下降的表型。
最后,高彩霞博士指出,通过回交转育方法将Tamlo-R32的编辑位点引入优良品系中可以得到既抗病又高产的小麦新品系,但该过程需要一次杂交,多次回交和自交,并需要分子标记辅助筛选,费时费力。而利用CRISPR/Cas9瞬时表达编辑系统直接编辑优良品系,可以在2-3个月内将R32位点引入到优良品系中。
综上,基因编辑可以快速可靠精准地创制农作物新品系;通过瞬时递送质粒DNA或者RNP可以实现高效、低脱靶、无转基因的基因编辑;基因编辑可以快速创制抗白粉病高产优良小麦种质资源,这对于开发具有广谱和持久抗病性的高产作物品种至关重要。
Caixia Gao博士做报告
在第三部分,Jonathan Weissman博士对基于CRISPR的单细胞技术追踪肿瘤演化、绘制基因型-表型谱定义基因功能的研究进行了分享。
首先介绍了CRISPR技术在调控基因表达及功能基因筛选的策略,研究人员可以利用CRISPR sgRNA文库进行功能基因的大规模遗传筛选,筛选针对群体细胞进行,在遗传筛选的起点和终点,细胞群体中gRNA的种类和频率会发生富集或丢失,gRNA指代了细胞的基因型,因此可以推测基因型与表型之间的对应关系。
基因筛选有助于推断哺乳动物细胞中的基因功能,但大规模测定复杂表型(如转录谱)仍然很困难。基于此,Jonathan Weissman实验室开发出Perturb-seq技术,结合单细胞RNA测序 (RNA-seq)和CRISPR扰动聚类分析,在一个文库中执行多种测定。
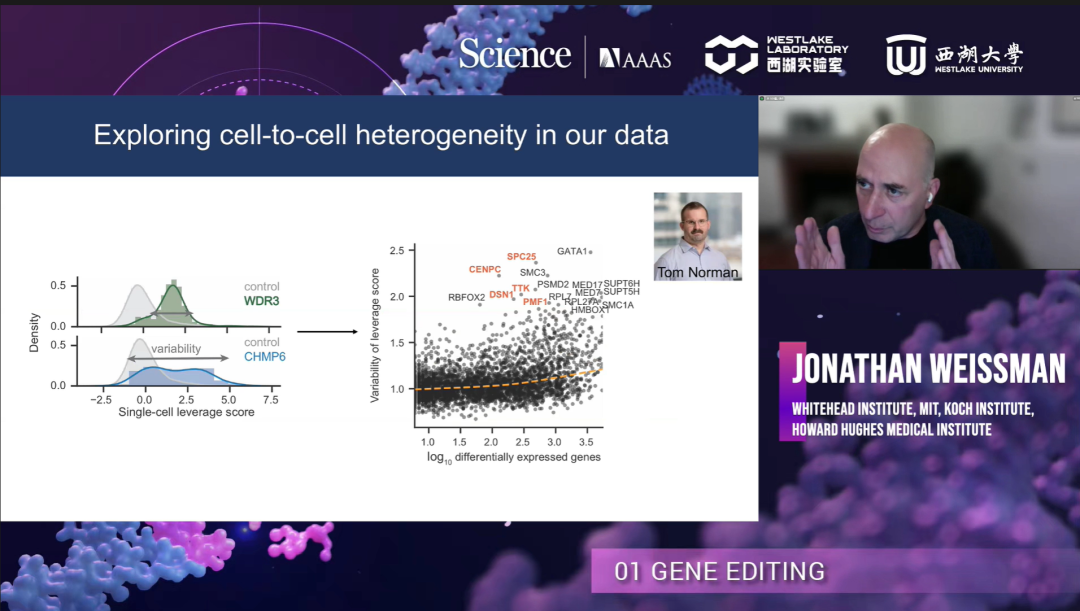
Jonathan Weissman博士实验室最新的研究是使用 CRISPR 干扰 (CRISPRi)靶向250多万个人类细胞,并进行Perturb-seq分析。从而反映出:数千种已知的对应关系并预测新的基因功能,例如核糖体生物发生、转录和线粒体呼吸等;揭示已知复合体中的功能子模块;探究了导致细胞与细胞之间异质性的驱动因素。
研究结果显示,由于染色体的随机增加或丢失,TTK 敲低细胞具有高度可变的核型,从而解释了它们的表型异质性。也可以通过数据结构的全局视图对基因型到表型之间异质性差异分析,包含染色体的不稳定、RNA的进程、细胞周期等。
Jonathan Weissman博士接下来介绍了实验室开发的“分子记录仪”技术,研究团队将基于单细胞RNA-seq的谱系追踪系统引入到KP小鼠模型中,连续并且全面的监测到一个携带致癌突变的单细胞演变成具有侵袭性肿瘤的全过程,揭示了罕见的亚克隆可以通过独特的转录程序驱动肿瘤扩张,同时发现了肿瘤通过典型、独特的轨迹演化,干扰额外的肿瘤抑制因子可以加速肿瘤的进程。
此外,研究团队还利用该技术研究了肺癌异种移植小鼠模型中转移的速率、途径和驱动因素。总体来说,该团队的研究展示了此技术能够以亚克隆分辨率和大规模追踪癌症进程的能力。
通过开发可应用于体内的Perturb-Seq技术,能够更有效的在动物模型中筛选功能基因,从而使我们能够在机理上理解这些基因突变是如何导致疾病的。新技术的组合应用,使研究人员能够操纵并研究单个细胞中的具体基因,在较高的水平上揭示出具体基因变化所带来的影响。
Jonathan Weissman博士做报告
本期研讨会不仅有精彩的报告和提问环节,两位主持人和三位嘉宾还共同参与了圆桌讨论,以“基因编辑”为主题,与大家分享他们的发现和发明,以及对生物学,医学和农业未来的看法。
嘉宾及主持人圆桌讨论
最新资讯
学术研究
学术研究
学术研究
大学新闻

















