
搜索网站、位置和人员

电话: +86-(0)571-86886861 公共事务部
北京时间2024年3月15日凌晨2点,《科学》杂志在线发表了题为《完全组装的次要剪接体与U12型内含子结合的结构基础》(Structural basis of U12-type intron engagement by the fully assembled human minor spliceosome)的科研论文,这是剪接体结构与机理研究的又一个重大突破!
这一成果来自西湖大学特聘研究员万蕊雪团队和结构生物学讲席教授施一公团队,第一作者是西湖大学副研究员白蕊。他们首次报道了完全组装的次要剪接体的高分辨率三维结构,展示了在U12型内含子上组装过程的关键构象——预催化剪接体前体(precursor pre-catalytic spliceosome,定义为“pre-B复合物”),解析并鉴定了56个蛋白和6种RNA(pre-mRNA和5种snRNA),整体分辨率高达3.3埃。
该结构第一次展示了组成次要剪接体的全部5种snRNP(U11、U12、U4atac、U6atac和U5 snRNP),揭示了次要剪接体在组装过程中对U12型内含子上5’剪接位点识别的分子机理,解决了剪接体激活过程中5’剪接位点如何逐步进入活性位点的重要问题;通过与主要剪接体的结构比较分析了U2型和U12型内含子识别的结构基础,首次从分子层面提出了主要、次要剪接体如何区分剪接位点并正确完成组装的模型。
2021年,万蕊雪&施一公团队首次在《科学》杂志发文报道次要剪接体相关成果(重大突破!西湖大学施一公研究组在《科学》发文报道世界首个人源次要剪接体的电镜结构),3年之后的今天,他们仍然是世界上唯一报道次要剪接体结构的团队。
万蕊雪、施一公课题组最新《科学》论文截图
论文链接:https://www.science.org/doi/10.1126/science.adn7272
一个耀眼的配角
不次要的次要剪接体
次要,并不意味着不重要,相反,在人体生命活动中,次要剪接体扮演着重要的角色,它们就好比电影中的配角,虽然出场次数不多,但却对剧情的发展起着至关重要的作用。
要理解次要剪接体,首先要理解什么是剪接体。
生物学最核心的法则之一“中心法则”,描述了自然界所有生物得以生存必需的基因表达过程——储存在DNA(基因)中的遗传信息通过“转录”被传递给信使RNA,再通过“翻译”从RNA传递给执行生命活动的蛋白质。
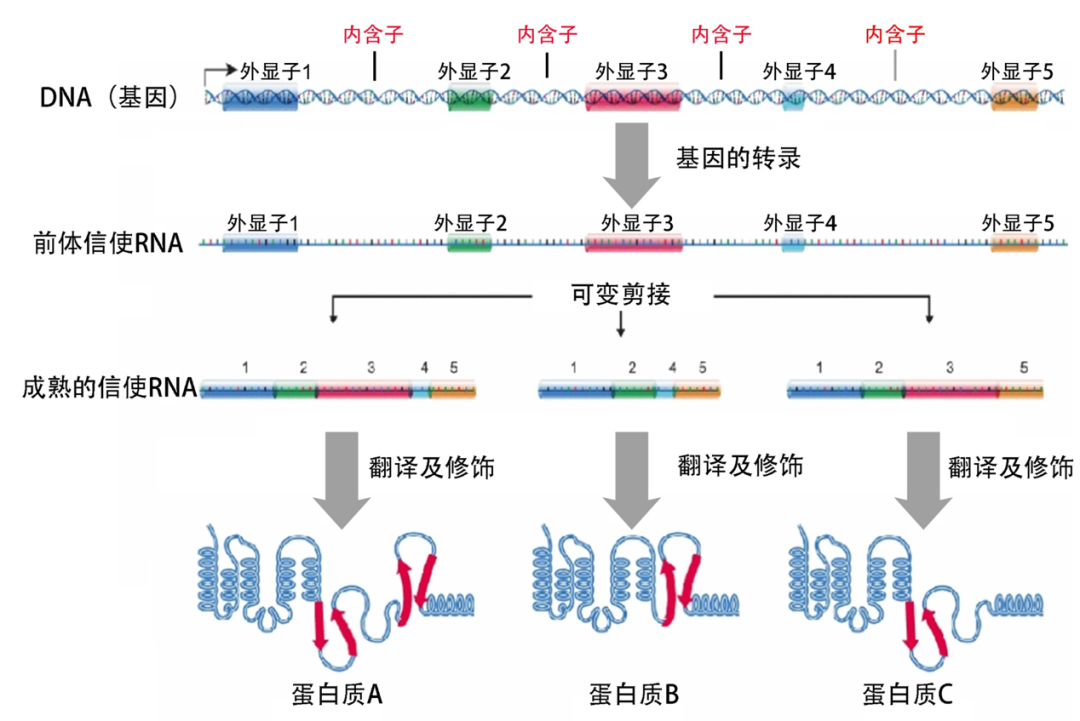
基因表达与RNA剪接
那么,基因中所有的信息都有效吗?如果不是的话,谁来承担甄别的角色呢?
如果说,每个人的基因是一部宏伟的电影剧本,那么,RNA剪接则是一位神奇的魔术师,轻轻一挥魔术棒,剪掉“无效”的遗传信息(内含子)、接上“有效”的信息(外显子),最终拼接成一部完整的人生电影,而这位魔术师手中神奇的魔法棒,就是剪接体——主要由上百种蛋白质和5条核内小RNA(snRNA)组成。
每一次剪接,剪接体需要首先识别剪接位点。在20世纪90年代,科学家在研究分析中发现了一类非经典的内含子剪接序列(5’剪接位点为AT,3’剪接位点为AC),一种全新的剪接体开始进入科学家的视野。经过研究发现,它与此前发现的剪接体相似却也不同——同样包含5条snRNA,但是其中四种是新的(U11、U12、U4atac、U6atac)。
由于发现较晚、在细胞内的含量很低(含量占所有剪接体的百分之一),这类剪接体被命名为次要剪接体(minor spliceosome,又被称为U12型剪接体)。那些含量较多的剪接体则被命名为主要剪接体(major spliceosome,又被称为U2型剪接体)。
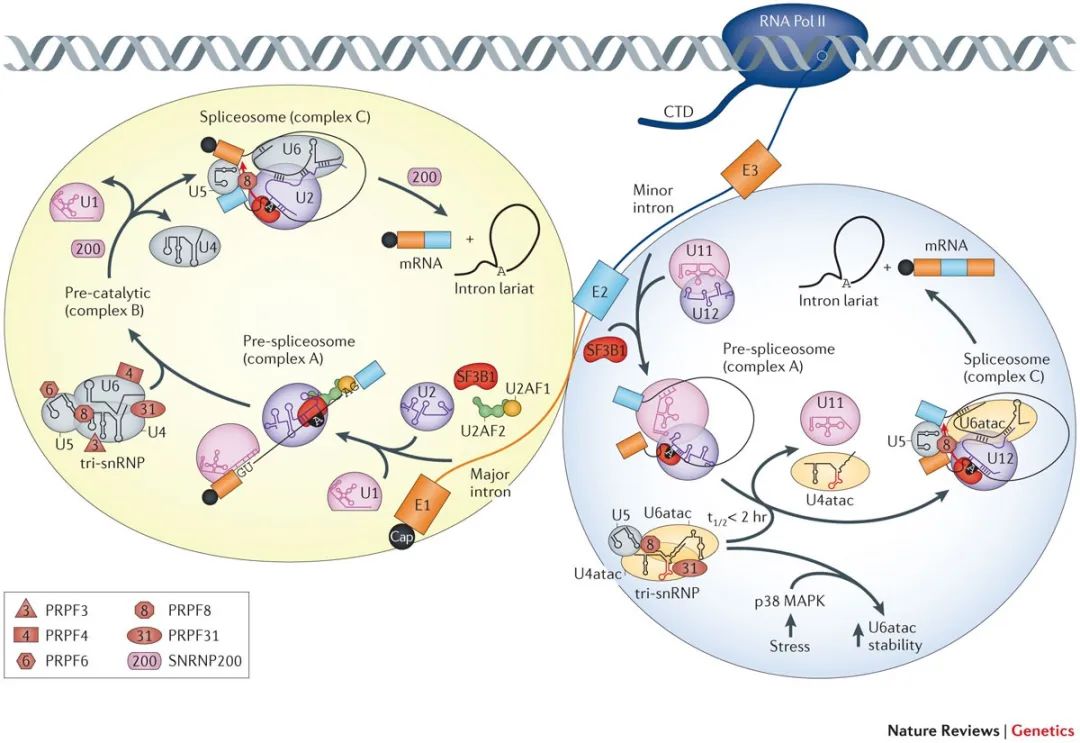
主要剪接体和次要剪接体
(Scotti and Swanson, Nature Review Genetics, 2016)
由此,次要剪接体开始出现在历史舞台上。但是针对它的研究却仅只有寥寥数笔,为什么?
因为含量极少,丰度只有主要剪接体的百分之一。这导致它们发出的信号会被占大多数的主要剪接体掩盖掉,也很难设计高效的体外实验。
其次,次要剪接体十分复杂,且十分不稳定,因此极难从细胞中被分离。
但是,这并不意味着次要剪接体不重要。
这些基因与许多重要的细胞基本生命活动密切相关:比如DNA的复制与修复、RNA转录与翻译、囊泡运输和电压门控离子通道活性相关的基因等。次要剪接的异常则会导致多种疾病的发生,如单纯性生长激素缺乏症、早发性小脑共济失调、骨髓发育异常综合征等。
因此,次要剪接体如何组装、催化?它由什么蛋白质组成?两条剪接通路如何区分、如何协作或相互影响?等等,这些问题亟待科学家探索和发现。
一份新年贺礼
解析完全组装的次要剪接体结构
2024年2月9日,除夕夜。伴随着零点钟声的敲响,万蕊雪的手机上突然跳出了新邮件提示:Science文章接收函!从投稿到接收,这篇文章只经过不到2个月时间,意味着编辑团队对其研究价值的高度认可。第一时间,她把这个好消息发在了团队群里,新年的烟花瞬间在这个小群绽放!
这个小群何时建立的,万蕊雪已经记忆模糊了。因为他们在剪接体这一领域已经深耕10年以上。
此前,在主要剪接体领域,他们解析出几乎全过程的10种状态的结构,对于主要剪接体的实验方法、性质特点都有着自己独到的见解。
而研究团队并没有忽视那不到0.5%的存在——次要剪接体。早在2018年,他们在规划剪接体未来研究计划时,就把次要剪接体列入计划当中。
2021年1月,Science报道了世界上第一个次要剪接体的结构,这是他们第一次敲开了次要剪接体的大门!
这次的成果正是上一次的延续。
完成RNA剪接,需要至少10个不同状态的剪接体,2021年解析的是次要剪接体激活的状态,此次解析的是激活与前一步组装之间的状态——预催化剪接体前体(Pre-B复合物),也就是要“剪”但还没开始的那一步,这是组装过程中最复杂的复合物。
打个比方,剪接体就像一个小型工厂,工厂的运转需要招募员工(蛋白质),Pre-B复合物就是所有员工到岗的那一刻的工厂,人最齐。因为一旦开工,人员就会外派到各地。想要看清这个“工厂”的构造,这个时刻最完整。
挑战难度极大,也无经验可循,研究团队决定走一条从未有人走过的路。
他们尝试从建立体外剪接实验入手。次要剪接体在细胞内含量极低,非常难分离纯化。纯化一次次要剪接体,就需要养40L的细胞,最终只能获得20微升浓度为0.2mg/ml的剪接体蛋白样品。也就是说,在两桶桶装水中,只有一滴水能派上用场,且成功率很低。
做一个冷冻电镜样品需要4微升剪接体蛋白,他们至少做了50个以上的样品。
次要剪接体是以底物为中心的,其他蛋白结合到底物上开始剪接,底物就好比地基,研究需要一条高效的底物来开展实验。于是团队改造了pre-mRNA底物,通过控制体外剪接反应的离子条件、加入关键“动力源”蛋白ATPase/Helicase PRP28突变体等方法,成功得到了次要剪接体pre-B复合物状态。
这个状态包含了组成剪接体的全部5种snRNP组分,但是依旧无法看清全貌,因为这个状态蛋白组成多且极不稳定,各snRNP之间的相互作用并不紧密,于是,团队通过增加化学交联剂的方法,使得剪接体处于“不紧不松”的状态。
最后通过10万张冷冻电镜照片的收集,经过复杂且漫长的数据分析过程,他们解析出了人源次要剪接体处于完全组装状态的高分辨率三维结构——拥有56个蛋白和6条RNA(pre-mRNA和5种snRNA)。次要剪接体特有组分中的U11 snRNP和U4atac/U6atac.U5 snRNP的三维结构被首次揭示。
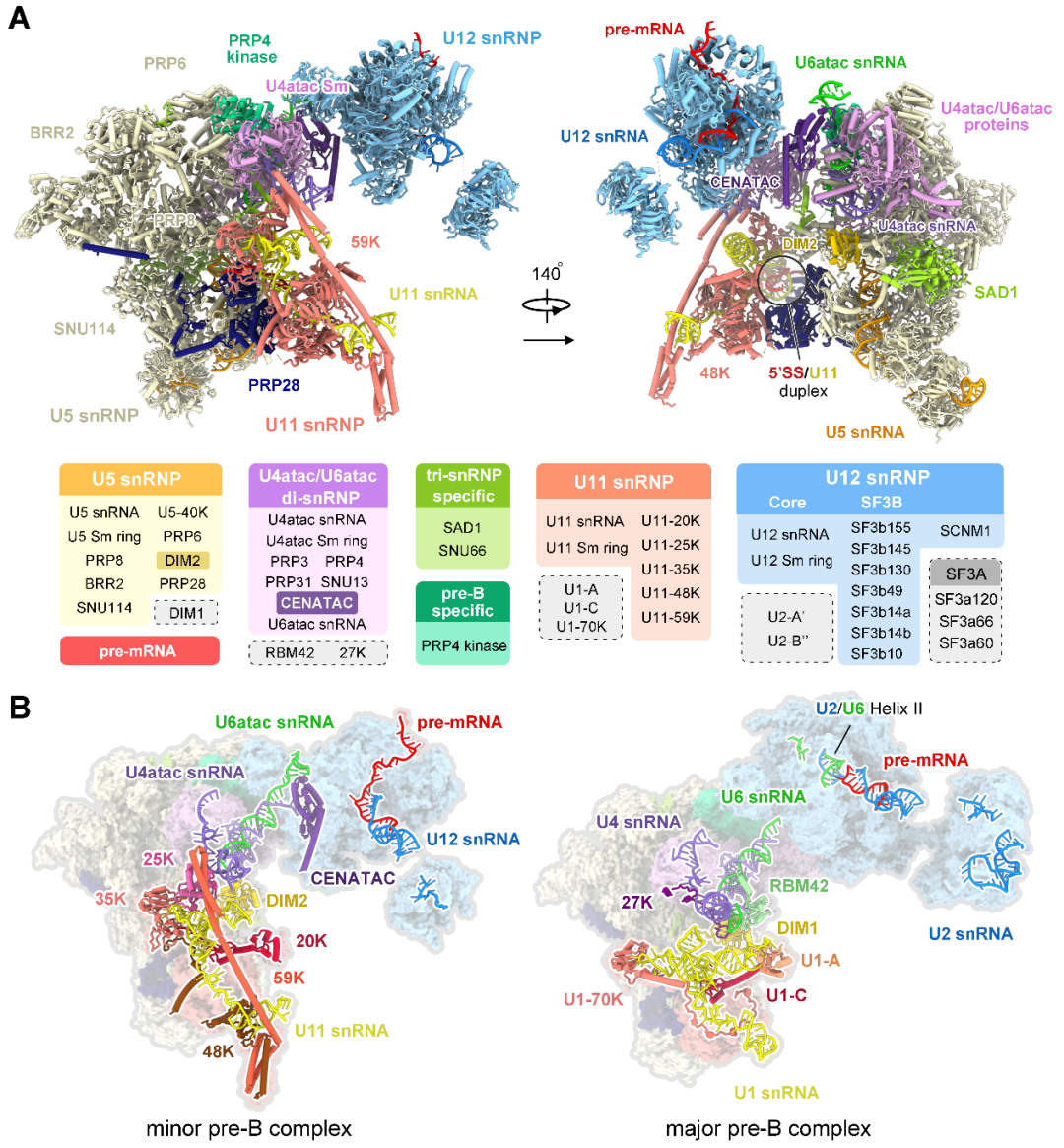
完全组装的次要剪接体的三维结构
一些重要发现
鉴定了次要剪接体新的特异组分
对比两张相似的图片,在规定的时间内找出不同的地方,这是大家小时候都玩过的游戏“找不同”。对于研究团队而言,科研工作也像一个升级版的“找不同”。当我们困惑于次要剪接体的神秘时,不仅想知道它们长什么样、怎么工作,它们与主要剪接体有什么样的不同,更重要的是,想知道这样的不同如何帮助区别两条剪接通路。
从2021年研究项目启动,到2022年春天,不到一年的时间,研究团队以最快速度解析出了高分辨率结构。
此前,我们已知主要剪接体中含有U1 snRNP,而次要剪接体中含有一个和U1 snRNP功能类似、却拥有十分独特的蛋白组成的U11 snRNP,但是二者为何如此不同却还是个谜。
解析结构之后,研究团队清楚地看到了U11 snRNP结构特征,12个蛋白参与识别并维持了独特的U11 snRNA的构象。更为重要的是,U11 snRNP部分的高分辨率结构清晰地揭示了U12型内含子5’剪接位点被U11 snRNP识别的结构基础。
然而,在次要剪接体preB complex的另一边,却还有一些组分没有被鉴定出来。
U4atac、U6atac两条snRNA被认为分别与主要剪接体中U4、U6 snRNAs具有类似功能,它们之间在序列上几乎没有相似性,但却折叠成了相似的三维结构,这很好地解释了为什么两条剪接通路中可以共用部分蛋白。可是在此之外,我们还清楚地看到,在这两条次要剪接体特有的RNA旁边,紧紧结合着一些未知的成分,但我们始终看不清它们的样子。
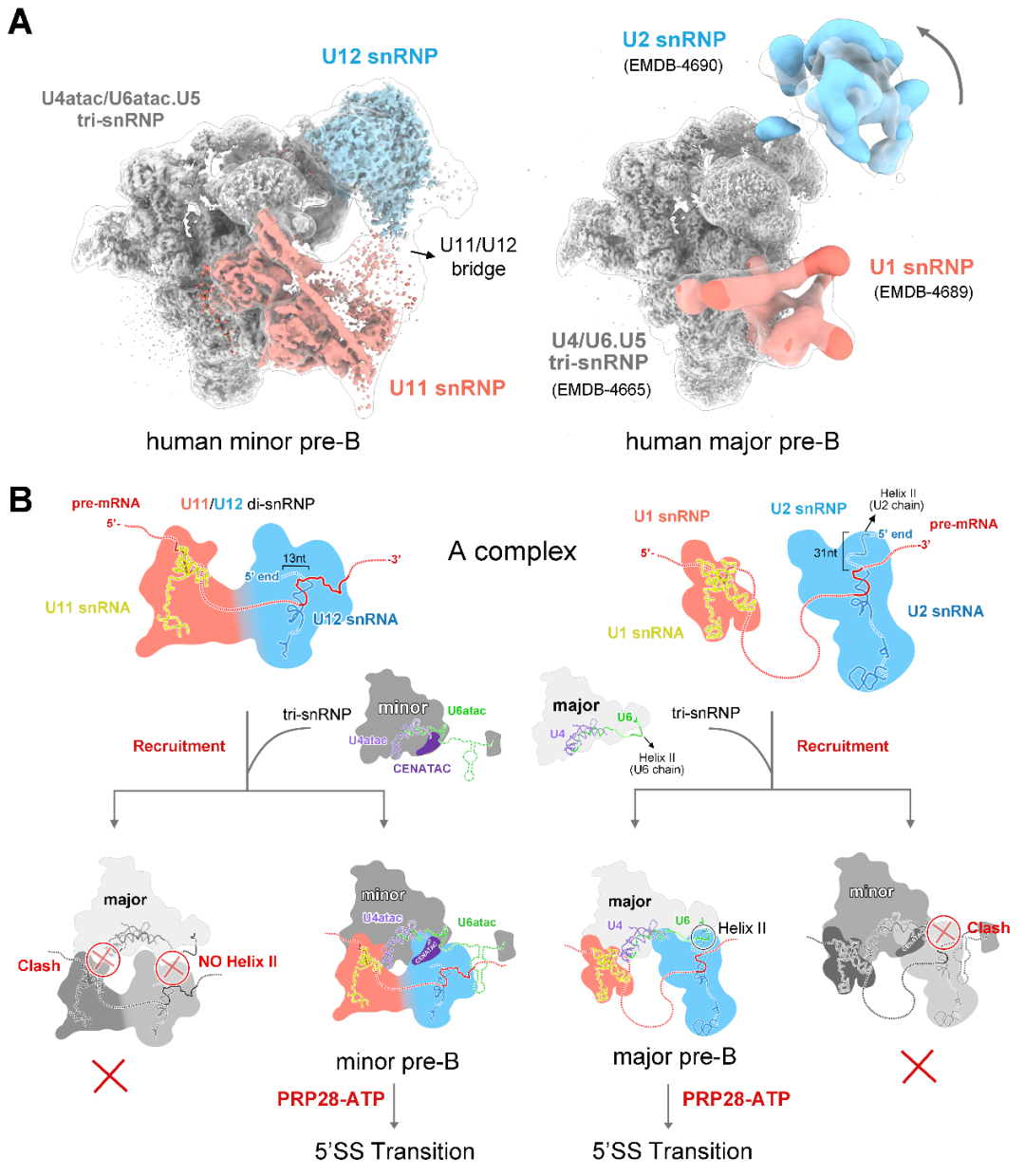
次要剪接体与主要剪接体的结构及组装机制差异
又经过近一年的实验、查找和鉴定,研究团队终于鉴定出了位于U4atac/U6atac.U5 tri-snRNP部分鉴定出两个次要剪接体的特异组分蛋白CENATAC和DIM2的结构信息。其中,CENATAC特异性识别U4atac snRNA的5’末端以及U6atac中部茎环结构。鉴定出的特异蛋白更好地解释了为什么次要剪接体和主要剪接体在招募成员的过程可以不出错。
次要剪接体中的U4atac/U6atac.U5 tri-snRNP和主要剪接体中的U4/U6.U5 tri-snRNP构象十分相似,在组装过程中,那些游离的蛋白如何“各就各位”?次要剪接体在门口竖起了标志——蛋白CENATAC和DIM2,那些游离的蛋白正确找到了对应的位置, 接下来的RNA剪接才得以顺利进行。
通过上述研究,团队首次提出了两种剪接体的正确组装的分子机理模型,为理解两条剪接通路间的精准识别奠定了重要的基础。
至此,这项研究才算划上了一个圆满的句号。
2023年,施一公首部个人作品《自我突围》出版,他在其中提到:
“2008年,刚过不惑之年的我全职回到母校清华,教书育人,研究探索。这一年,我做了一个大胆的决定:在科研上,用很小一部分力量延续来自普林斯顿的科研课题,而把大部分力量投入崭新、高风险、没有任何成功把握但激动人心、令人痴迷的研究方向……”其中之一就是真核生物剪接体的结构,这是结构生物学领域公认的世界性难题。
当时,施一公连5%的胜算都没有,不确定这些方向能否做出成果,也无法预知要花多少年才能做出成果。之后,万蕊雪和白蕊先后加入研究组,整个团队合力奋斗了十几年。
创新就是走一条前人没有走过的路。多少次,他们经历内心的焦虑和挣扎,多少次,他们因为说服不了对方而争得面红耳赤。这个时候听谁?他们不约而同给出了共同的回答:“谁有理听谁的,施老师也是这样,甚至鼓励我们‘唱反调’。”
毕竟,吾爱吾师,吾更爱真理。

西湖大学剪接体团队(万蕊雪、施一公实验室)
西湖大学生命科学学院特聘研究员万蕊雪、讲席教授施一公为本文的共同通讯作者;西湖大学生命科学学院副研究员白蕊为本文的第一作者;清华大学生命学院博士生袁梦、科研助理张普和西湖大学生命科学学院科研助理罗婷参与了部分生化研究。北京协和医院教授黄超兰和原高级工程师高帅鑫在质谱分析方面提供了帮助;清华大学冷冻电镜平台主管雷建林博士及工程师杨帆博士在冷冻电镜数据收集方面提供了帮助;西湖实验室副研究员黄高兴宇在数据处理方面提供了建议。电镜数据采集于清华大学、西湖大学冷冻电镜平台,计算工作得到西湖大学和清华大学高性能计算平台的支持。本工作获得了西湖教育基金会和国家自然科学基金委的经费支持。
万蕊雪实验室介绍

万蕊雪,西湖大学生命科学学院特聘研究员、博士生导师,2013年于中山大学获学士学位,2018年于清华大学获得博士学位,随后在清华大学从事博士后研究。曾入选2016年度“未来女科学家计划”、获2018年度Science & SciLifeLab国际青年科学家奖、2018年瑞士乔诺法(Dimitris N. Chorafas Prize)青年研究奖、2020年亚太地区蛋白质学会首届青年科学家奖等。
万蕊雪博士系统的研究剪接体和RNA剪接分子机理已有10余年,期间取得了许多重大成果,共发表论文20篇,以第一作者和通讯作者身份在Science、Cell期刊发表论文14篇,捕获、纯化并解析了世界上第一个近原子分辨率的剪接体三维结构,该成果被写入国际权威的生化教科书(Lehninger Principles of Biochemistry)并当选封面,10年间取得的系列研究成果填补了RNA剪接机理研究的空白,开辟了U12型剪接研究的新篇章,为相关疾病的致病机理和治疗方案奠定了基础。目前实验室将从结构生物学、生物化学、细胞生物学和生物信息学等多方面开展关于RNA的剪接和调控、RNA加工等过程的工作机理研究,长期招聘博士后和科研助理,研究方向不限,科研助理优先考虑有攻读西湖大学博士意愿的同学,欢迎感兴趣的同学一起探究RNA剪接世界,请发送简历至wanruixue@westlake.edu.cn。
最新资讯
大学新闻

















