
搜索网站、位置和人员

电话: +86-(0)571-85270350 公共事务部
北京时间11月24日,《分子细胞》(Molecular Cell)在线发表了题为Structural Basis for the Modulation of Human KCNQ4 by Small-Molecule Drugs的研究论文。该研究解析了人源KCNQ4通道蛋白及其与小分子药物结合的复合物的高分辨率冷冻电镜结构,将为增进理解KCNQ通道蛋白的工作机理及设计与优化相关靶向药物提供良好的结构基础。
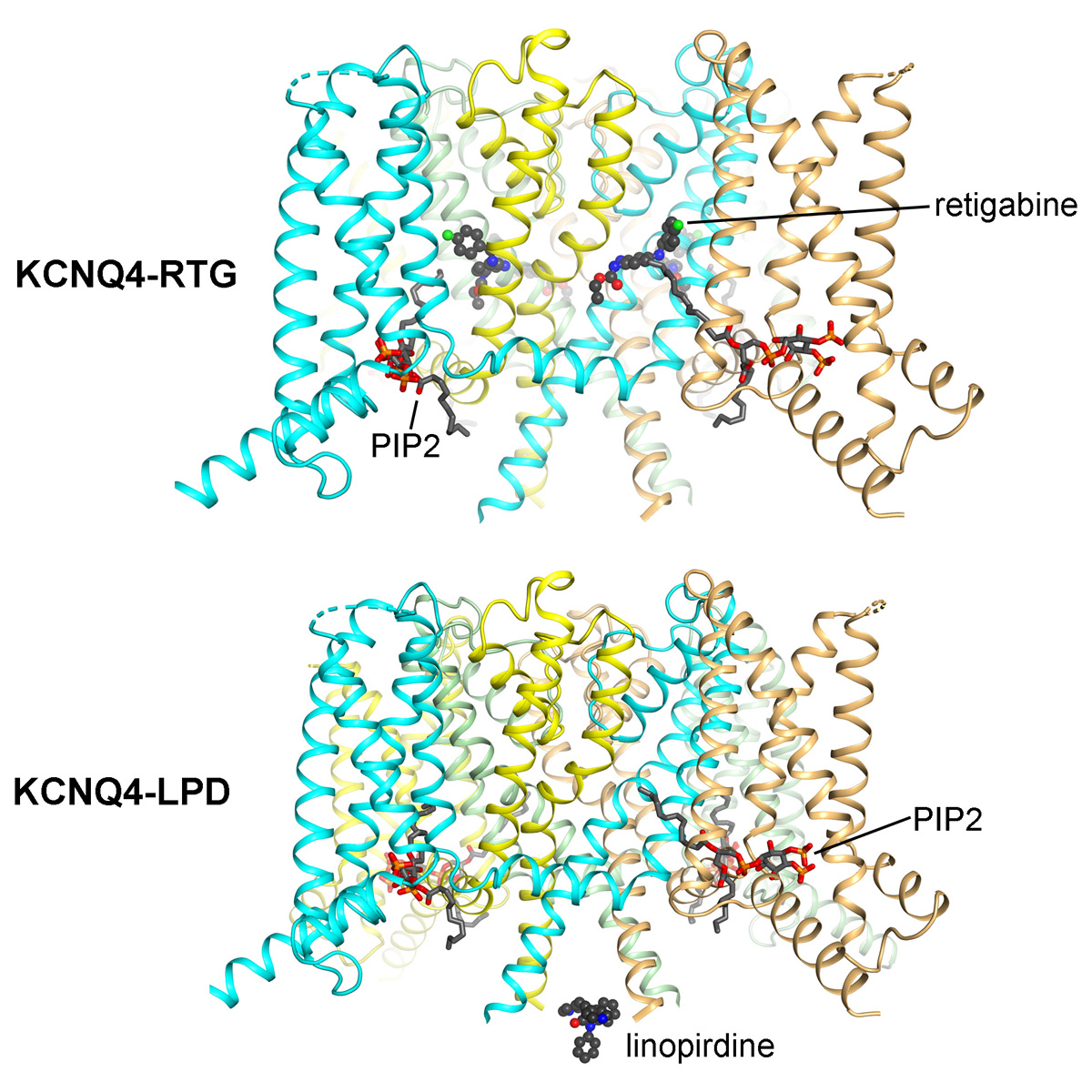
人源KCNQ4通道蛋白与瑞替加滨或者利诺吡啶复合物的结构。
西湖大学生命科学学院特聘研究员申怀宗为通讯作者,申怀宗课题组博士后李恬、首都医科大学附属北京朝阳医院吴坤博士、申怀宗课题组科研助理岳振雷为并列第一作者。

全文链接:https://www.sciencedirect.com/science/article/pii/S1097276520307711?dgcid=author
人的中枢神经系统由脑和脊髓组成,通过对神经信号的传递、加工、整合和存储,负责生命维持、决策、记忆等神经活动,并实现对全身各部位的精细控制。
那神经系统这个“总司令部”是如何工作的呢?原来神经系统靠的是名为“动作电位”的神经活动:当神经元在接收到足够强的神经递质(传递信息的化学物质)等刺激时会产生电信号,也就是发出和传递“指令”。拿古代战争中用烽火传递军情的场景来比拟,信号一旦生成,就像有个“火把”被点燃了,会在神经系统内沿着一个个“烽火台”进行传递。钠通道(只能通过钠离子的离子通道),是烽火台负责点火的“士兵”;而钾通道(只能通过钾离子的离子通道),则是负责熄火的“士兵”。
在博士与博士后期间,申怀宗和同事一起揭开了一系列负责“点火”的钠通道的“面纱”,包括解析了第一个真核钠通道NavPaS的高分辨率冷冻电镜结构、真核钠通道和重要天然毒素的复合物结构和人源负责疼痛传递的Nav1.7的冷冻电镜结构等。在加入西湖大学后,他所领导的膜蛋白结构生物学实验室,把目光投向了负责“灭火”的钾通道。
人体里有四十多种电压门控钾通道(即由电压信号控制开闭的钾通道),它们负责神经元和肌肉细胞等可兴奋组织的兴奋性调节,对维持神经-肌肉系统和心脏的正常功能来说非常关键。KCNQ通道蛋白,分布在心脏和神经系统中,正是这样一类有着重要功能的电压门控钾通道,其编码基因的突变可导致癫痫、耳聋、神经性疼痛和心律不齐等严重疾病。
此前,针对该类钾通道的结构生物学研究主要集中在心脏中的KCNQ蛋白上(即KCNQ1),而对于神经系统中的KCNQ蛋白(即KCNQ2-5)却知之甚少。例如,它们是否有着和KCNQ1相似的结构?为什么心脏KCNQ蛋白(KCNQ1)对于瑞替加滨(retigabine)这一靶向神经系统KCNQ通道蛋白的、治疗癫痫的药物不敏感?可否依据结构信息进一步增进瑞替加滨的选择性以降低甚至消除其副作用?靶向KCNQ蛋白的阻断剂利诺吡啶(linopirdine)的作用位点又在哪里?
带着这些关键的问题,申怀宗课题组瞄准神经系统的KCNQ蛋白,展开了攻关。利用先进的冷冻电镜技术,首先,他们解析了人源KCNQ4通道蛋白的2.5Å的高分辨率结构,“看清”了这个蛋白:这是一个同源四聚体,4个电压感受结构域环绕着中心的一个通道结构域。在电压发生变化后,电压感受结构域会“打开”位于中心的通道结构域,让钾离子通过。基于此,他们将KCNQ4的结构与KCNQ1(即心脏中的KCNQ蛋白)进行了比较。


KCNQ4和KCNQ1的结构比较。
更进一步,他们解析了KCNQ4与治疗癫痫的药物瑞替加滨(retigabine,缩写为RTG)的复合物的3.1 Å分辨率结构。RTG是一类激活剂,特异地作用于神经中的KCNQ蛋白,帮助打开钾通道。该药物曾在欧洲和美国上市,被用于治疗复发难治性癫痫。然而,该药物在患者中引发了一系列较为严重的副作用,症状包括皮肤掉色、视网膜病变、膀胱储尿能力下降等——2017年,RTG以退市收场。
申怀宗介绍:“之前的研究表明,KCNQ2和KCNQ3组成的复合物M通道,是瑞替加滨治疗癫痫发作的关键靶点。副作用的产生据推测是因为瑞替加滨额外激活了在外周神经系统发挥功能的KCNQ4、KCNQ5,比如KCNQ4就与膀胱上的括约肌收缩控制有关。新药开发的经济、时间和人力成本都很高,如果我们能够通过结构生物学的方法分辨出这些神经系统的KCNQ蛋白之间的药物结合差异,就能对现有的RTG药物进行针对性的优化,降低甚至消除副作用,使之重新帮助到癫痫患者。”

激活剂瑞替加滨与KCNQ通道蛋白的结合情况分析。
根据所取得的结构,申怀宗团队不仅“看清”了RTG与KCNQ4的结合位点,而且通过结构分析,他们还揭示了RTG激活KCNQ通道蛋白的机理,及其对于神经和心脏KCNQ通道蛋白的选择机理。这些关键发现将有利于对现有的RTG药物进行优化,有望提高它对与癫痫直接相关的蛋白复合物M通道的选择性。
同时,研究人员还揭开了KCNQ4和可能的增强认知的药物利诺吡啶(linopirdine,缩写为LPD)的结合结构,分辨率为3.3 Å。LPD作为阻断剂,能够阻断钾通道;与RTG不同,它对神经与心脏中的KCNQ都能起到作用。目前,LPD仍处于动物实验的阶段,尚未被应用于临床;尽管如此,LPD是目前KCNQ阻断剂中经常被研究的一类药物。

阻断剂利诺吡啶与KCNQ通道蛋白的结合情况分析。
依据解析的高分辨率结构,申怀宗实验室发现了LPD与KCNQ4的结合位点位于蛋白的胞质侧,首次找到了LPD抑制KCNQ4的作用位点。“如果把KCNQ蛋白比喻成人,先前关于LPD药物的结合位置,我们连它究竟是结合在头部、在手上、或者是在脚上都还不知道;通过冷冻电镜下的结构,我们现在可以精确地知道这种药会‘附着’在‘人’身体的什么部位了。“申怀宗说。令人意想不到的是,一般来说,阻断剂都会作用在蛋白的胞外侧或者通道结构域内部,“把守”钾离子进入蛋白的“外侧大门”或者连接“内外侧大门”的走廊;而本研究显示,LPD这种阻断剂却是在“内侧大门”的里面“堵住”钾离子的通过的。

每个电压感受结构域结合一个通道激活必需的PIP2分子。
该项研究的另外一个意外发现是在KCNQ4蛋白的4个电压感受结构域里,每个均包含一个紧密结合的PIP2(磷脂酰肌醇二磷酸)分子。PIP2是KCNQ通道蛋白激活所必需的磷脂分子。也就是说,当神经电信号传递到这类蛋白时,只有当PIP2小分子存在时,允许钾离子通行的“大门”才会打开。该发现为进一步理解PIP2激活KCNQ蛋白的机理,及为何这类小分子是这种通道开放所必需的提供了基础。
此外,本次研究所取得的结构生物学的发现,均由首都医科大学附属北京朝阳医院的吴坤博士进行了电生理实验的验证。电生理实验,可以理解为通过在体外人为地施加电压,在表达了通道蛋白的细胞上形成动作电位。
未来,申怀宗课题组将继续深入研究KCNQ蛋白家族,增进对其工作和致病机理的理解。同时,基于这些更进一步的理解,尝试设计并优化靶向KCNQ蛋白的相关药物。
西湖大学申怀宗课题组致力于运用生物化学和结构生物学的方法,对离子通道等重要膜蛋白的工作和致病机理开展研究,长期招聘single particle cryo-EM, cryo-ET和neurobiology等方向优秀博士后,待遇从优。
欢迎投递简历至:shenhuaizong@westlake.edu.cn
最新资讯
人物故事
大学新闻

















