
搜索网站、位置和人员

电话: +86-(0)571-86886861 公共事务部
北京时间2021年3月19日,周强课题组在《细胞研究》(Cell Research)杂志在线发表了题为“Structural basis for the different states of the spike protein of SARS-CoV-2 in complex with ACE2”(“新冠病毒S蛋白结合ACE2多种状态的结构基础”)的文章,深入研究了新冠病毒S蛋白结合细胞受体ACE2过程的构象变化,进一步阐释了S蛋白入侵人体宿主细胞过程的分子机制和结构基础。
新冠病毒目前仍在世界范围内广泛流行,给各国人民的生活带来了巨大冲击。研究显示,新冠病毒是借助表面S蛋白(全称为刺突糖蛋白,Spike Glycoprotein)结合人体宿主细胞表面的ACE2蛋白,通过宿主蛋白酶切割S蛋白使之发生一系列构象变化,释放S2膜融合肽,将病毒遗传物质输入宿主细胞,完成侵染过程的。
周强课题组一直致力于研究新冠病毒入侵人体细胞的分子机制,先后解析了新冠病毒细胞受体ACE2全长蛋白及其与新冠病毒S蛋白受体结合结构域复合物的高分辨率冷冻电镜结构,揭开了新冠病毒入侵人体的神秘面纱。
在本次研究中,团队成员系统地解析了新冠病毒S蛋白的多个结构,包括S蛋白闭锁状态(locked)和激活状态(active)的两种构象,S蛋白结合受体ACE2羧肽酶结构域(PD)的多个高分辨率结构,经过胰蛋白酶切割后的S蛋白与PD结构域结合的多个高分辨率结构,以及S蛋白与全长ACE2复合物的完整结构。文章深入分析了S蛋白在结合ACE2过程中的构象变化特征,发现S蛋白受体结合结构域(RBD)在从闭锁状态到预激活状态(active-down)和完全激活状态(active-up)过程中,和临近N端结构域(NTD)的接触面积逐渐减少;同时,当S蛋白和PD结合时,经胰蛋白酶切割处理后的S蛋白倾向于结合更多的PD分子,表明胰蛋白酶切割的过程中可能使S蛋白的RBD处于更易结合ACE2的激活状态。
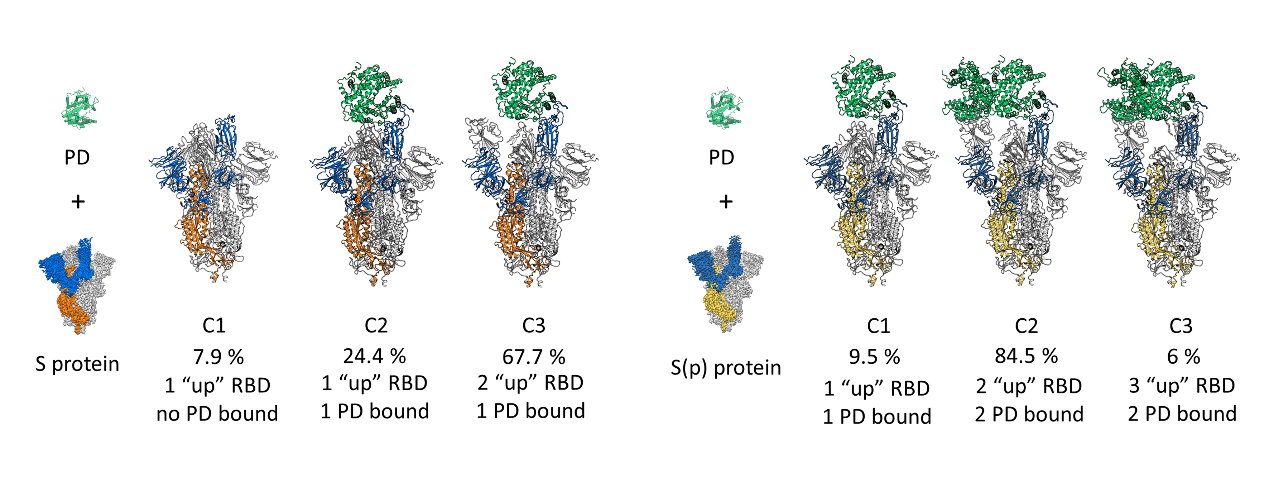
S 蛋白及其与ACE2的PD结构域结合后的不同构象(左);经酶切的S 蛋白与ACE2的PD结构域结合后的不同构象(右)
此外,文章还分析了此前报道的S蛋白D614G突变体,发现该突变体经胰蛋白酶处理后,相比于野生型S蛋白有更多的切割条带,表明该突变可能改变了S1/S2区域的柔性状态,使其更容易被激活而侵染宿主细胞。值得一提的是,文章还探究了更接近生理状态下的全长ACE2和S蛋白的结合情况,首次报道了全长ACE2结合S蛋白的完整结构。研究发现,全长ACE2二聚体中的单体能够分别结合一个S蛋白三聚体,从而证实了此前的推测。作者还发现了更多的现象,包括S蛋白三聚体上的两个RBD可以分别结合一个全长ACE2的二聚体,即“肩并肩”的两个ACE2可与同一个S蛋白三聚体结合,以及多个S蛋白三聚体和多个ACE2二聚体分子串联形成的更大的复合物。这表明S蛋白和ACE2在体内可能有更复杂的相互作用,为深入理解S蛋白介导的病毒侵染细胞机制提供了更为重要的线索和基础。

新冠病毒S蛋白与受体ACE2全长二聚体分子的复合物结构
西湖大学研究员周强、西湖大学博士后鄢仁鸿为本文共同通讯作者。鄢仁鸿博士、周强课题组科研助理张媛媛及清华大学博士生李雅宁为本文的共同第一作者。本项目得到国家自然科学基金、浙江省重点研发计划、杭州市领军型创新创业团队计划、腾讯基金会、西湖教育基金会等的支持。冷冻电镜数据和处理得到了西湖大学冷冻电镜平台和西湖大学高性能计算中心的支持。
文章链接: https://doi.org/10.1038/s41422-021-00490-0
最新资讯
遇见WeMeet
通知公告

















